PH10の溶液中ではカルシウムもマグネシウムもイオンの状態(Ca 2 とMg 2 )で存在しますので,両方ともキレートを生成します(全硬度).pH12ではマグネシウムは水酸化物Mg(OH) 2 になり,キレートを生成しないと考えられます(Ca硬度).さらに強い塩基性ではカルシウムも水酸化物Ca(OH) 2 になり,キレートを生成しないと予想されます.しかし,EDTAや指示薬がその · キレート滴定でphを一定に保つ理由がわかりません。 滴定に際して反応の有効安定度定数を一定にする必要が在るから。 例えば金属イオンM^2をEDTA(H4Y)で滴定する場合、絶対安定度水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを
グルタミン 構造式 シアン化水素 クチコミ Stevenjoneslu Over Blog Com
キレート滴定 ph 理由
キレート滴定 ph 理由-以上のことからphが ひくくなるとhの 濃度増加 のためedta錯 塩が不安定になり,phが 高くなると水 酸化物生成のためedta錯 塩の分解がおこり, edta 錯塩が安定なのは一定のph領 域に限られていることが わかりますそ してそのph領 域は金属イオンの種類にキレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。




塩酸はなぜ酸性を示すのか 塩酸の性質や化学式 反応性について詳しく解説 ジグザグ科学 Com
キレート滴定 がった理由を考える必要がある。 0 10 30 40 50 0 30 60 90 1 (mg/L)224 実験2. <目的>土壌についてカルシウム量の測定を行い, 植物との生長の関係を調べる。 <仮説>カルシウムの土壌改善効果により,土壌に化学実験指針 千葉工業大学教育センター化学教室編 学術図書出版社 153 第4版 第1編 実験の心得(実験上の心得;実験技術(一般操作法));第2編 実験項目(Fe3+、Al3+、Cr3+の反応;化学的酸素要求量(COD)の測定;pHの測定と 中和滴定 ;ビクトルマイヤー法による分子量測定;凝固点キレート滴定(キレートてきてい、chelatometric titration )とは、錯滴定の一種で、錯形成試薬としてキレート試薬と呼ばれる多座配位子を用いるもの。 この容量分析法は金属 イオンの迅速で簡単な定量法の1つとして広く用いられている。 主なキレート試薬としてEDTA(エチレンジアミン四酢酸
· A ベストアンサー 理由1:金属イオンとキレートが結合する強さ(安定度定数)は、pHによって変化する。 pHが低いほど結合は弱くなるので、できれば高pH域でやりたい。 理由2:しかし、金属イオンはpHが高くなると水酸化物の沈殿になり、キレート滴定できない。 水酸化物が出来ないpH領域でなければならない。 理由3:キレート剤は酸であり、金属イオン薬が知られており、滴定しようと思う金属イオンの種類及び滴定 時の ph によって選択することができる。edta が広範囲の金属 イオンとキレート化合物を生成するという性質は、edta を用い るキレート滴定法の汎用性を意味すると同時に選択性に乏しいこ1 キレート滴定法の原理 2 指示薬の性質 3 器具の構造と規定 (中和の場合は、pH 読み取り、滴定後の使用量を求める(jis k 0050 附属書 c
ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。 · キレート滴定の実験の課題で、 「キレート滴定では、緩衝液を加えて液のphを一定に保っている。 なぜphを一定に保つ必要があるか、理由を述べなさい。 · そこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。




Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由




京都電子工業株式会社
· pHが酸性であり、弱酸が水中で完全には解離していない ことがわかっています。滴定を開始したら、弱酸とその塩または酸性陰イオン の両方が存在する緩衝域(10~90%中和)が現れるのです。この緩衝域で塩基 を加えても、pHはわずかしか変化しません。PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。)を加えてよく振り混ぜ、1分間放置する。 ③NN指示薬01 gを加え、EDTA標準溶液でNN指示薬の赤色が青色となり、赤みがなくなった時が終点である。3回の滴定の平均をとる。



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ



77 2 硫酸アンモニウム飽和溶液 Ammonium Sulfate Saturated Solution 019 011 詳細情報 試薬 富士フイルム和光純薬
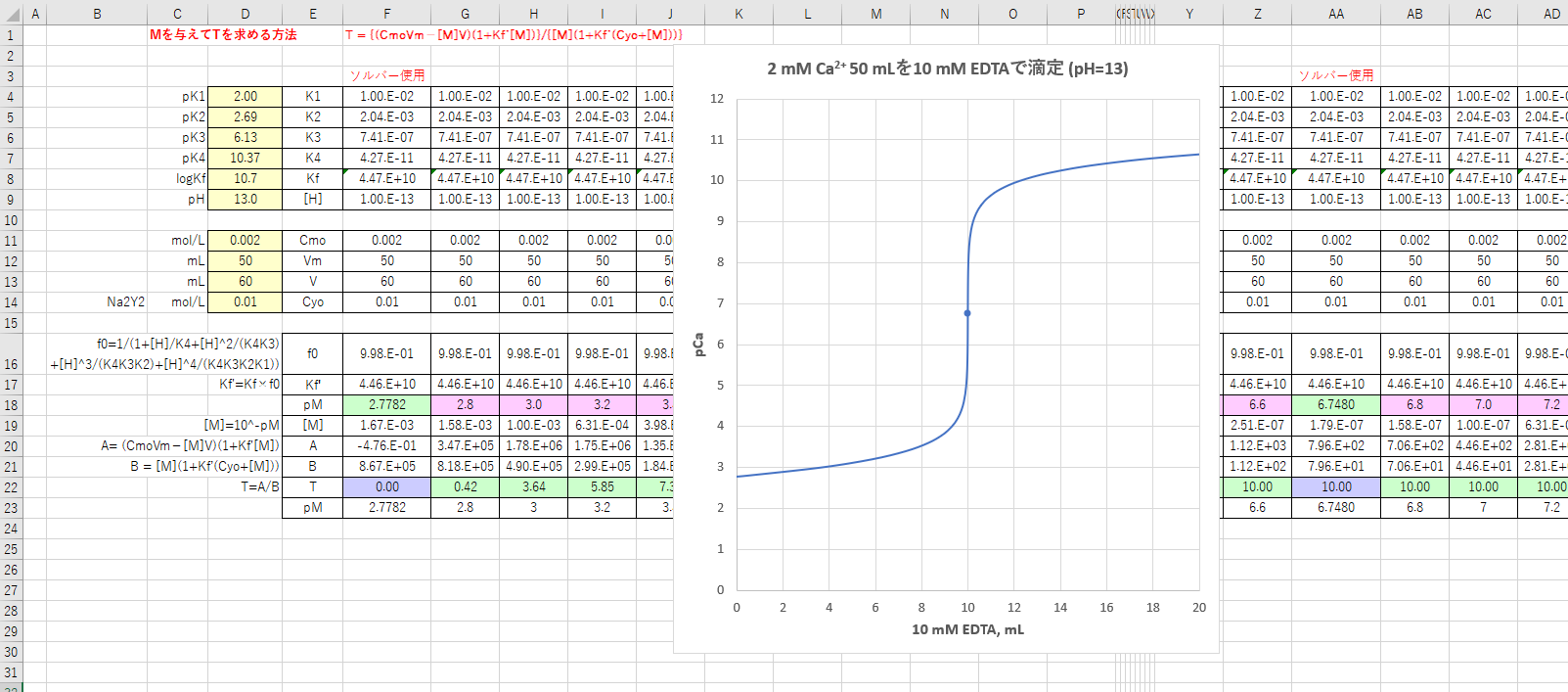
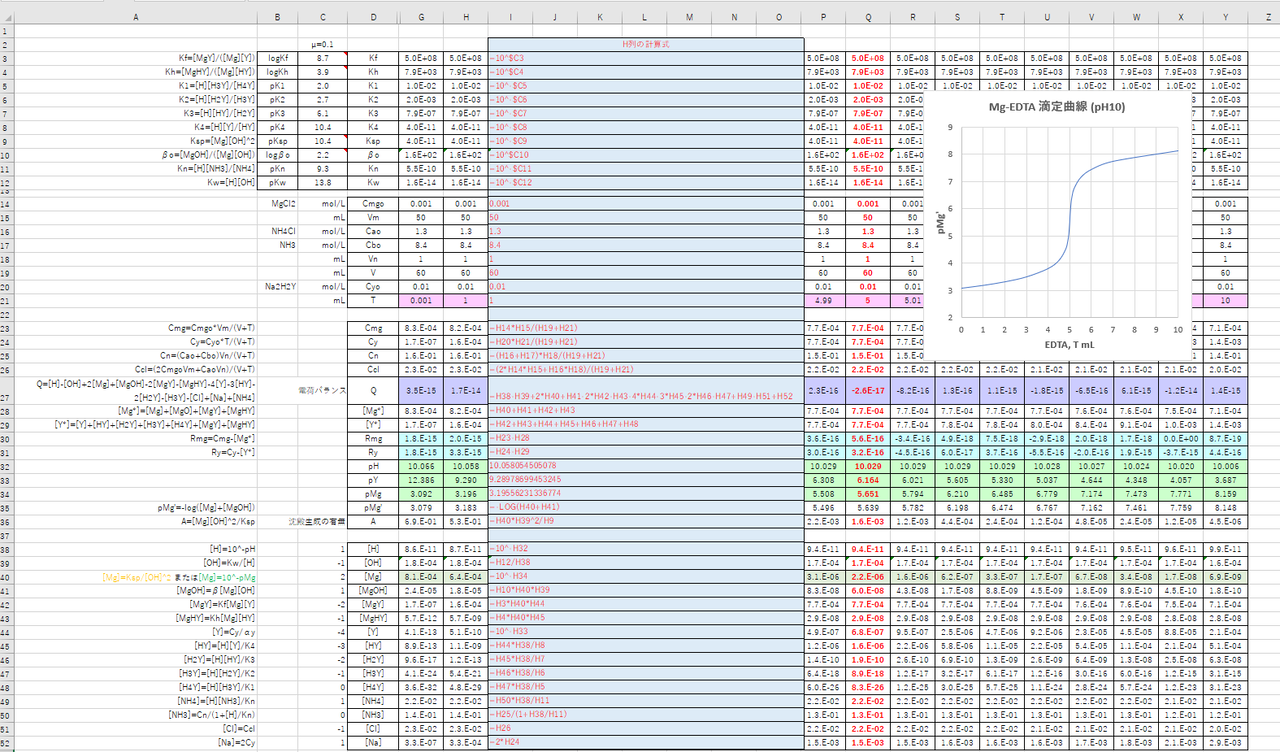
PH=7 では、Mg 2+ を有効数字4桁で滴定するには適当ではなく、pH=10 が必要。また、pH=7 での M gの滴定曲線は当量点で pMg のジャンプが小さいので終点を検出できないが、pH=10では検出亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多法法法法という。EDTAは水にほとんど溶けないので、キレート滴定では水に溶けやすいEDTA ・2Naを用いる。 全硬度の測定は、試料水のpHを約10 に調整した後,BT指示薬を加えて、EDTA溶洷 で滴定して求める。




Woa1 低毒性ソホロリピッド含有組成物及びその用途 Google Patents



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
· dna分解酵素阻害剤としてのキレート剤 dna分解酵素であるdnaseは,その活性発現にmg 2 を必要とします. そして,teのバッファーの "e" は, edta のことです. dnaの保存で teバッファー を使う理由は以下の2点です. ・phを塩基性に保つことで,dnaを脱プロトン化して沈殿す普通の滴定に使う濃度ではこのようなことは起こりませんが、濃度が高いとOHが ABS at pH 52 nm、λ2 of max ABS at pH 68 5590 nm。pK 63。pH などが存在すると、キレートを作って赤色になります。これにEDTAを加えると、BETよりもEDTAの方が強いのでNhk高校講座 化学基礎 第32回 中和滴定 nhk 「強酸」の塩酸と「強塩基」の水酸化ナトリウム水溶液で中和滴定するときは、中和点のpH



グルタミン 構造式 シアン化水素 クチコミ Stevenjoneslu Over Blog Com




電位差自動滴定装置 メトロームジャパン株式会社 のカタログ無料ダウンロード 製造業向けカタログポータル Aperza Catalog アペルザカタログ
キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA ( ) pH = 57の場合、分子形:イオン形 =1:10である。 ( ) pH = 47の場合、分子形分率は50 %である。EDTAを加えるとキレート効果で置換されるためNN、BTは遊離して青を示す。 高pH条件ではMgが水酸化物沈殿を生じるため、pHの変化のみで定量が可能。 (3) トリエタノールアミンを加えた理由 EDTAとの錯生成に干渉する金属イオンのマスキング(特にAlやFe)キレート滴定法の発表された初期にお いては金属指示薬としてはエリオTや ム レキシドしかなかったが,こ れらは,い ずれもアルカリ性においてのみもちいら れる指示薬であるから,金属指示薬をも ちいるキレート滴定法の応用できる pH




Jpa 可溶性ヘテロ二量体レセプター及びその使用 Google Patents



Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由
キレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。PH 10 でキレート滴 定すると,pCaはEDTA溶液を50 mL滴下した当量点付近で急激に増大する。 この急激な変化を利用すると,滴定の終点を検出できる。pH 12 では更に大 * Ca2 = c Y = x と考える。 図62 0010 M EDTA による0010 M Ca2(50 mL)の滴定に及ぼすpH の影響




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com




Pdf Ck 19 Kh
ホールピペットを用いて,Mg 2 を含む試水10 mLを100 mLビーカーに取る. 緩衝液(Na 2 B 4 O 7 ‐Na 2 CO 3, pH 10) 2 mLをメートルグラスで測り取り,加える.示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域で




I へ 1 F 22 1 B 1 0 騨劉 1j 11 菫驍 二あたごで 籟轌鱗鞠菖 Lif 風 胸 量 一躍 1 L 丸 迄渋澤 11 齢哩醇 13 琴




I へ 1 F 22 1 B 1 0 騨劉 1j 11 菫驍 二あたごで 籟轌鱗鞠菖 Lif 風 胸 量 一躍 1 L 丸 迄渋澤 11 齢哩醇 13 琴
在させることは必要であるが、MX指示薬(ムレキシド)を使用して銅の滴定を行う場 合のpH限域は8であるので、NH3水を過剰に用いることはさけなければならない。 この滴定における反応は次のとおりである。 Cu2+H 2Na2Y → CuNa2Y +2H 操作Q18 キレート滴定法で行う硬度分析. q17 電解水をよう素滴定法で分析する原理. q10 塩化亜鉛水溶液に塩酸を少量加え,亜鉛板と銅板を接触させて入れて高温を保つと,銅に亜鉛が析出する理由.Ie キレートは酸性では解離し易くなる ところで、キレート滴定が定量的であるためには、 Kf´> 10 8 または、 log Kf´>8 であるから、この条件を満足する pH (下限の pH )が存在。 Ex Cd 2+:Kf=400 ×10 16 or log Kf=166 log αH=log Kf−log Kf´= 166 −8=86




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog




塩酸はなぜ酸性を示すのか 塩酸の性質や化学式 反応性について詳しく解説 ジグザグ科学 Com
キレート滴定では、pH の設定に注意を払う必要がある。 まず EDTA が直接的にキレート生成にかかわるのは四価の負イオンとしてであるが、pH が低くなると四価の負イオンとして溶存する量が減少し、キレート生成が押さえられるようになる。性質 一般にEriochrome Black Tと呼ばれる色素で、金属のキレート適定用指示薬や比色定量試薬として使用される。 BTは水、アルコールに溶け易いが、有機溶媒には溶け難い。水溶液は、pH<6で赤色、pH7~11で青色、pH>12で橙色となる。酸解離定数はpK a2 =63,pK a3 =115(μ=008,℃)で、多くの金属キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63




17 号 シリカまたは金属ケイ酸塩析出物を抑制または除去するためのフルオロ無機物 Astamuse




Jpa アネキシンvの製造プロセス Google Patents
· 理由1:金属イオンとキレートが結合する強さ(安定度定数)は、pHによって変化する。 pHが低いほど結合は弱くなるので、できれば高pH域でやりたい。 理由2:しかし、金属イオンはpHが高くなると水酸化物の沈殿になり、キレート滴定できない。 水酸化物が出来ないpH領域でなければならない。 理由3:キレート剤は酸であり、金属イオンと結合する際 · http//wwwhatenanejp/# <化学>キレート滴定関連で質問です。 滴下する溶液に、KOHを加えるのですが、pHを高くする為に使用する。 という事ですが、どんな作用で何でその必要があるんですか? ま 人力検索はてな URLはダミーです。 今配位子をY4としますと、pHが低い条件ではHが多く存在するので、Y4とHが反応してしまいます。 その結果HY3レポートを書く上で必ず調べて欲しい事項 ① 緩衝液は水溶液のpH(水素イオン濃度)をほとんど変化させ ない働きをもつが、その理由を化学的に説明して下さい。 ② キレートをつくるか否かで水溶液の色が変化するが、 このことを金属指示薬と金属



Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由



質問箱



Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由




I へ 1 F 22 1 B 1 0 騨劉 1j 11 菫驍 二あたごで 籟轌鱗鞠菖 Lif 風 胸 量 一躍 1 L 丸 迄渋澤 11 齢哩醇 13 琴




17 号 金属錯体製剤 Astamuse




Woa1 Glove Dipping Composition Method For Manufacturing Gloves And Gloves Google Patents




18 号 デフェラシロクスの改善された製剤およびその作製方法 Astamuse




トリスヒドロキシメチルアミノメタン Wikipedia




Jpa 鉄鋼材料用表面処理液および表面処理方法 Google Patents




分析化学i 京大の過去問を淡々とうpするblog




I へ 1 F 22 1 B 1 0 騨劉 1j 11 菫驍 二あたごで 籟轌鱗鞠菖 Lif 風 胸 量 一躍 1 L 丸 迄渋澤 11 齢哩醇 13 琴




Jpa Conjugate For Medical Imaging Comprising A Carrier A Targeting Moiety And A Contrast Agent Google Patents




ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ




1999 1017号 滴定制御方法 Astamuse




Woa1 粒子状吸水剤の充填方法および粒子状吸水剤充填物のサンプリング方法 Google Patents




07 号 キレート剤の測定方法およびキレート剤の測定キット Astamuse




Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由



ロシュ ダイアグノスティックス Mycotoolシリーズ 培養 製品情報 試薬 富士フイルム和光純薬



Ew 91回基礎完成




Images Of 中和滴定 Japaneseclass Jp



0 件のコメント:
コメントを投稿